每週五早上都固定有醫療產業組的夥伴在交流,今天想特別分享其中一個夥伴的專業,是在做 IRB 和透過科學數據分析,找出具有產品力美妝產品的廠商,希望這篇內容對有在尋找 IRB 的廠商有幫助!!
自己的生醫背景
對於生醫這塊的理解,就只限之前擔任日本 KPMG 生醫創投總經理的隨身翻譯,和永齡基金會的生醫孵化器 H.Spectrum 時的學習。而從孵化器畢業之後,就比較沒時間更深入暸解,如今有這樣的產業學習小組,也幫助我從產業內部更理解實際運作情況。如果大家在尋找 IRB 的廠商,很推薦尋找自然楓生醫!

IRB是什麼?
IRB是「人體研究倫理審查委員會(Institutional Review Board)」,主要負責審查牽涉人體研究的倫理原則,其目的是為了保護研究對象(受試者)權益與安全。
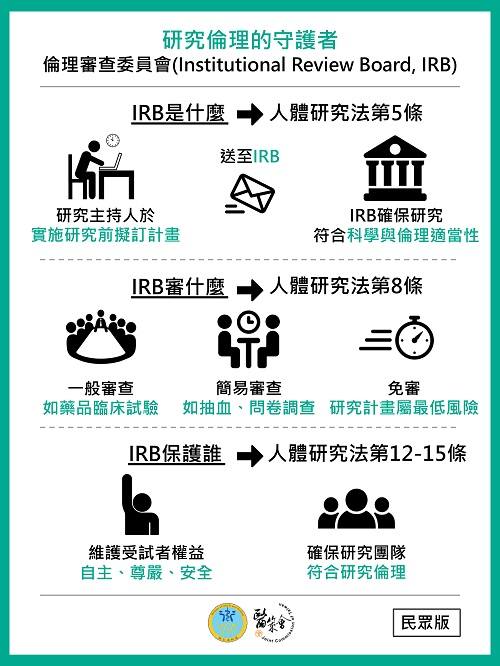
IRB為何重要?
還記得當天分享的朋友是位地區型醫院的朋友,他在做的工作,是協助送審 IRB。
很多大型藥廠與科技廠,如果想要進軍醫療產業正式跟醫生接觸,都會被要求通過 IRB 審核,而他就是負責去檢查案件,看有哪些項目如果要通過 IRB,還會需要相關單位去做補件的。
正由於並非每間醫院都有這樣的單位,所以最近有幾家想進軍醫療產業的科技配備公司,也都有經由他去審理,因此聽到很多之前不知道的事。
IRB審核項目有哪些?
IRB審核通常依研究案件類型進行審查
- 一般審查:如藥品臨床試驗
- 簡易審查:如抽血、問卷調查
- 免審:研究計畫屬最低風險
垂直型領域的深入
隨著越來越理解醫療產業不同角色之間的關聯,也對於整體醫材的銷售現場越來越清楚,像是
- 通常醫材廠商透過怎樣的方式推廣商品?
- 實際拜訪醫生時,會碰到哪些困難,又該怎麼解決?
- 要如何快速接觸大量的醫師,誰手上擁有最多醫生管道?
- 在異業結盟時,有哪些點可以加速效果產生
尋找專業的公司協助IRB審核嗎?歡疑聯絡自然楓生醫

自然楓生醫在台灣美妝產業擁有13年經驗的專業公司。擅長運用科學儀器數據找出產品力,並透過有效性實證找出產品信任度。
自然楓生醫的專業項目
自然楓生醫具備以下能力專長:美妝趨勢洞察、差異化商品開發案、美妝品牌策略定位以及TFDA化妝品法規。
公司強項
美妝、醫療器材功效認證、美妝PIF檔案管理、IRB申請、創新商品開發、臨床實驗。
自然楓生醫透過數據分析,協助找出具有產品力的廠商
自然楓生醫使命是透過科學數據分析,找出具有產品力的美妝產品。願景是成為美妝產業中信賴度高且以科學數據為基礎的領先企業。我們的價值觀包括專業洞察、科學數據驅動和持續創新。
過往合作單位
自然楓團隊曾在工研院、清大自強基金會、青創創新品牌經理培訓、中山基金會創新商業模式等機構擔任培訓講師,並在弘光科技大學、靜宜大學、中原大學授課。
自然楓生醫聯絡資訊
- 電話:02-28082006-0
- 信箱:[email protected]
- LINE: (@)377ocgre
延伸閱讀